



Le monde de l’ophtalmologie a très récemment fait un grand pas vers l’avant. Le 25 mai dernier à Paris, une équipe internationale de chercheurs a permi à un patient aveugle de naissance de retrouver partiellement la vue.
Dirigée par les professeurs José Alain Sahel et Botond Roska, en association avec l'Institut de la Vision, regroupant la Sorbonne Université l’Inserm et le CNRS, l’hôpital d’ophtalmologie des Quinze-Vingts, l'université de Pittsburgh, l'Institut d'ophtalmologie moléculaire et la clinique de Bâle (IOB) ainsi que les sociétés Streetlab et GenSight Biologics, l’équipe a pu restaurer la vision d’un patient atteint de rétinopathie pigmentaire avancée.
La rétinopathie pigmentaire (RP) est une maladie provoquant la cécité progressive. Elle est héréditaire, monogénique ou rarement digénique, et est causée par des mutations de plus de 71 gènes différents.
Elle touche plus de 2 millions de personnes dans le monde.
Le seul traitement de la rétinopathie pigmentaire (RP) était alors le recours à une thérapie génique, qui ne pouvait être envisagée que dans un cas très spécifique de RP précoce, touchant une mutation génétique du gène RPE65. En dehors de ces conditions, aucun autre traitement n’a jamais été approuvé.
L’équipe de chercheurs a conduit un traitement expérimental sur un patient atteint de RP non-syndromique avancée, en combinant l'injection d'un vecteur optogénétique avec le port d'un dispositif médical, à savoir des lunettes de stimulation lumineuse (lunettes GS030 - voir photo).

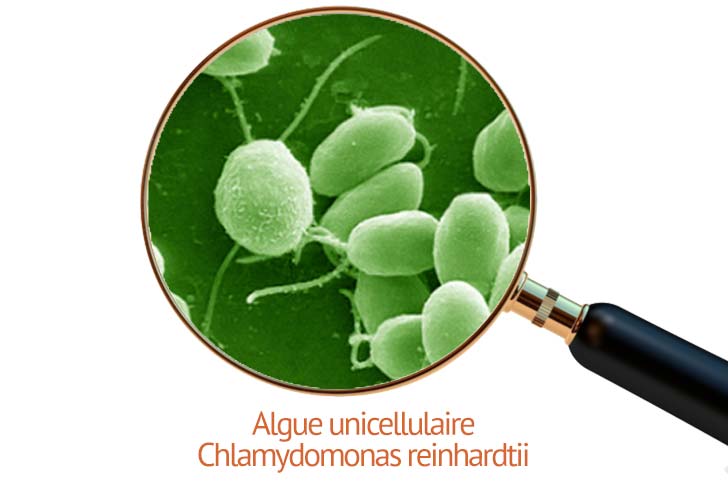
L’optogénétique est un domaine de recherche associant les connaissances de la génétique à celle de l’optique. Le but de la discipline est de stimuler avec précision des neurones, cellules du cerveau, génétiquement modifiées pour être sensibles à la lumière bleu. Les neuronnes sont ainsi sensible grace à l'injection d'un vecteur optogénétique, une protéine, l’opsine, tirée d’une algue unicellulaire.
Cette protéine photosensible, découverte en 2003 par Georg Nagel, Ernst Bamberg et Peter Hegemann est nommée channelrhodopsine 2.
En d’autres termes, le but de cette technique est de rendre des neurones sensibles à la lumière.
La protéine est injectée dans des neurones grâce à un virus adéno-associé, un virus inactif, non pathogéne. Les neurones ainsi génétiquement modifiés deviennent photosensibles. Une fois exposés à la lumière bleue, ils s’activent, et déclenchent des potentiels d’action, c’est-à-dire des messages électriques.
Le traitement a été administré directement dans l’œil le plus mal voyant du patient, par une seule injection intra-vitréenne, afin de cibler principalement les cellules ganglionnaires de la fovéa. Cette zone se trouve au fond de l’oeil, et permet à l’œil humain de développer sa meilleure vision des détails.
Elle est le centre de la rétine, organe de la vision qui permet la transition des informations lumineuses captées par les lentilles naturelles de l’œil, en informations électriques, transmises par le nerf optique au cerveau, et décodées par ce dernier sous forme d’images.
Les chercheurs ont également beaucoup plus poussé les manipulations génétiques, en modifiant la protéine channelrhodopsine, afin de ne pas la rendre sensible à la lumière bleu, mais à la lumière rouge. Tendant vers une couleur ambrée, cette dernière est moins sollicitée naturellement par l’œil humain que la lumière bleu, utilisée pour activer de nombreux autres capteurs. Les lunettes de stimulation lumineuse capturent des images du monde visuel à l'aide d'une caméra neuromorphique qui détecte les changements d'intensité, pixel par pixel, en tant qu'événements distincts. Les lunettes transforment ensuite ces événements en images monochromatiques et les projettent en temps réel sous forme d'impulsions lumineuses ambrées sur la rétine du patient.
Le patient, un homme de 58 ans diagnostiqué RP à l’âge de 18 ans, qui possédait une acuité visuelle limitée à la perception lumineuse, a développé grâce au traitement une récupération partielle de sa vision.
Durant les 84 semaines de traitement, le patient à été suivi médicalement, et aucune inflammation intraoculaire, aucun changement dans l'anatomie de la rétine, ni aucun événement indésirable oculaire ou systémique au cours de la période de suivi n’a été constaté.
L'oeil traité a conservé sa perception de la lumière.
Les résultats observés, par l’action conjuguée de l’injection de la protéine, et l’emploi des lunettes de stimulation lumineuse sont sans appel : le patient a retrouvé la vue.
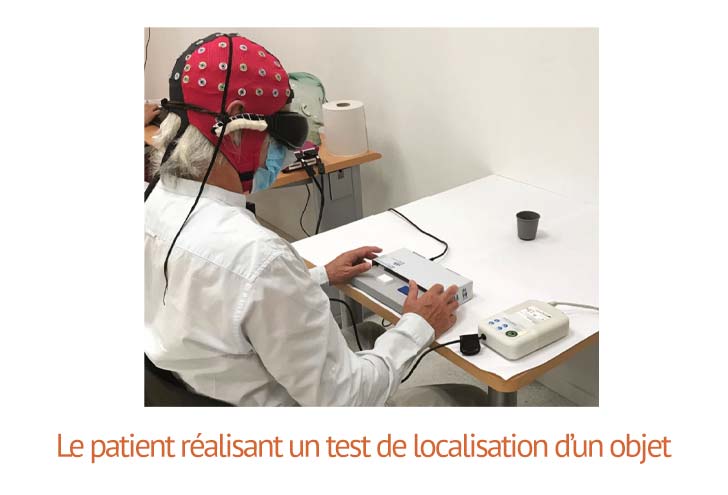
Pour mettre en évidence ces résultats, des tests contradictoires ont été réalisés : Des objets de tailles variables ont été posés sur une table à proximité du patient.
Sans les lunettes, le patient ne les a pas vu. Il n’a pas tenté de toucher les objets, étant dans l’incapacité de les localiser.
Stimulé par les lunettes, le patient a en revanche systématiquement identifié au moins un objet : 92% du temps, il identifia le plus gros des objets, un bloc-note de 12 cm x 17 cm, et dans 36% des cas, il a été capable d’identifier le plus petit (une petite boite d’agrafes). Le patient a été en outre capable de saisir l’objet identifié, et de le manipuler, démontrant une capacité de repérage spéciale, liée a sa perception visuelle nouvelle.
Un deuxième test, consistant à décompter des gobelets placés à différentes positions du patient, a démontré sa capacité à décompter des objets, et à les localiser dans une grande majorité des situations, avec les lunettes. Sans l’action des lunettes, le patient ne les percevait pas.
Cette découverte est un événement majeur dans le monde de l'ophtalmologie et de la neuroscience. En guérissant par l'action combinée des neurones et de la lumière, la vision d'une personne atteinte de cécité pendant 40 années de sa vie, les chercheurs ont réalisé une prouesse technologique, porteuse d’avenir et d’espoirs pour toutes les personnes souffrant de cécité héréditaire complète ou partielle.
Cette découverte est à l'image de celle ayant perm l’aboutissement de la chirurgie réfractive, telle que nous la pratiquons à l'Institut Bordelais de la Vision.
À l'image des premières pratiques de Kératotomie radiale, ancètre de la chirurgie refractive monderne, cette technique est révolutionnaire, et aboutira, nous l'esperons, à des techniques chirurgicales nouvelles, telles que l'ont été la PKR, ou le lasik, par laser femtoseconde.
Comme la chirurgie refractive de la myopie, cette opération pourra peut-être libérer des personnes dépendantes d'une maladie optique depuis leur enfance.
Comme la chirurgie réfractive de l’hypermetropie, qui met fin définitivement au port des lunettes correctrices, cette opération pourra peut-être mettre fin définitivement à la cécité.
Comme des personnes astigmate obligée de porter des lentilles de contact, et qui n'en portent désormais plus, des personnes ayant toujours été dans l'obscurité pourront peut-être retrouver la lumière.
Comme les personnes atteintes de presbytie, des patients de tous âges, pourront peut-être retrouver l’usage de leur vision.
Tout comme la myopie et l'hypermétropie, l'astigmatie et la presbytie, l'avenir pour les maladies héréditaires provoquant la cécité s'annonce obscure pour ces dernières, et lumineux pour les personnes qui en souffrent depuis de nombreuses années.